杉山 暁

杉山 暁(すぎやま あきら)
東京大学 アイソトープ総合センター 助教
研究内容
「次世代標的型放射性医薬品プラットフォームの研究開発」
放射性核種を的確に標的へ届ける技術の開発
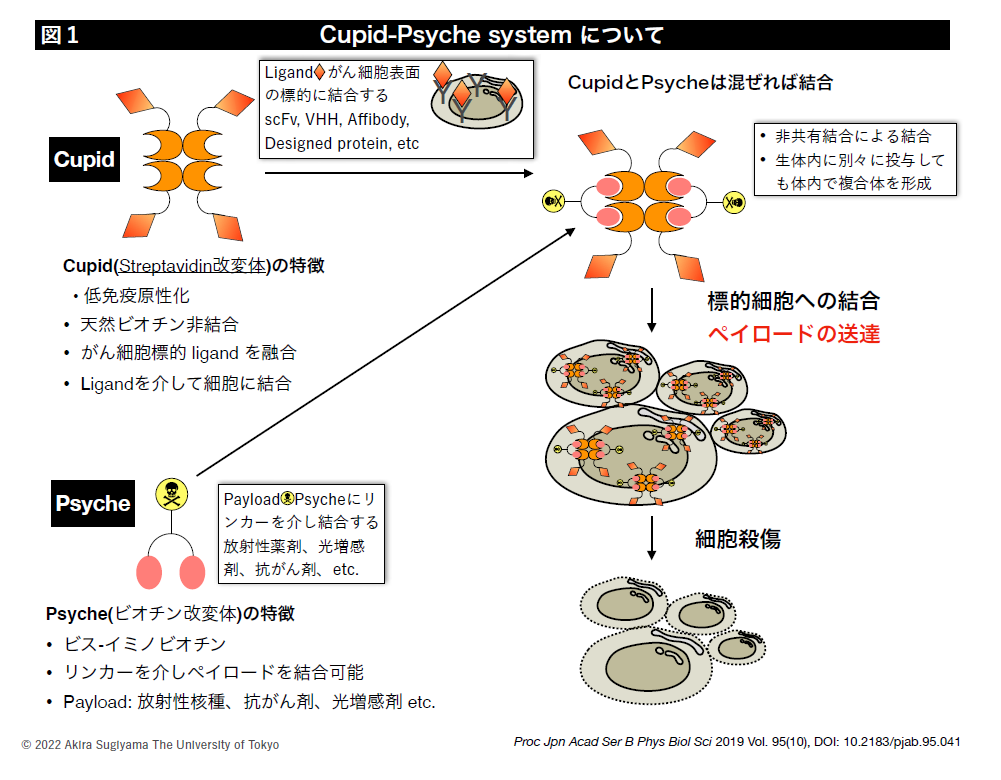
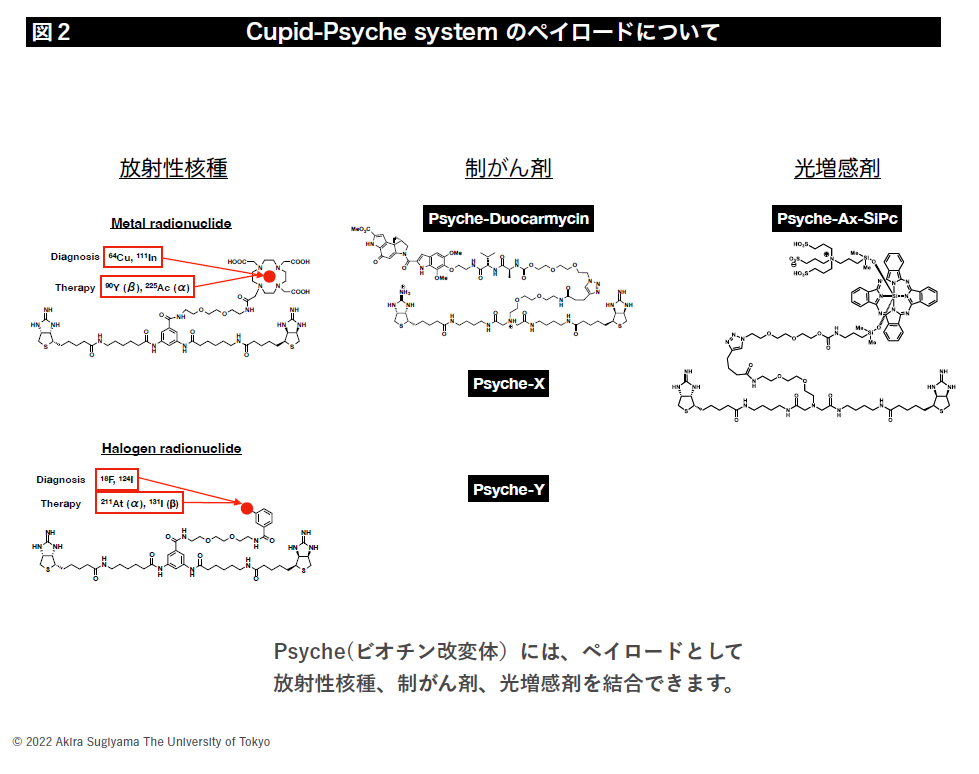
我々は、多数の分子標的に対し様々な薬で治療しうる次世代の抗体薬物複合体の開発を進めています(図1)。現在、送達できる薬剤(ペイロード)は、放射性核種(診断用、治療用)、光増感剤、制がん剤があります(図2)。
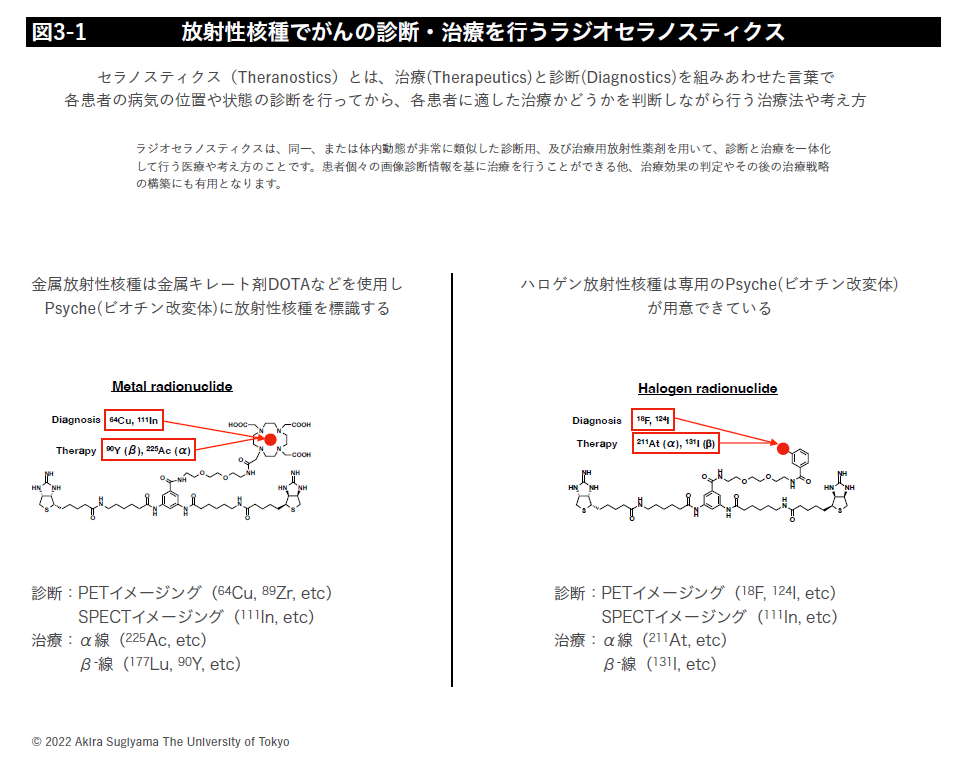
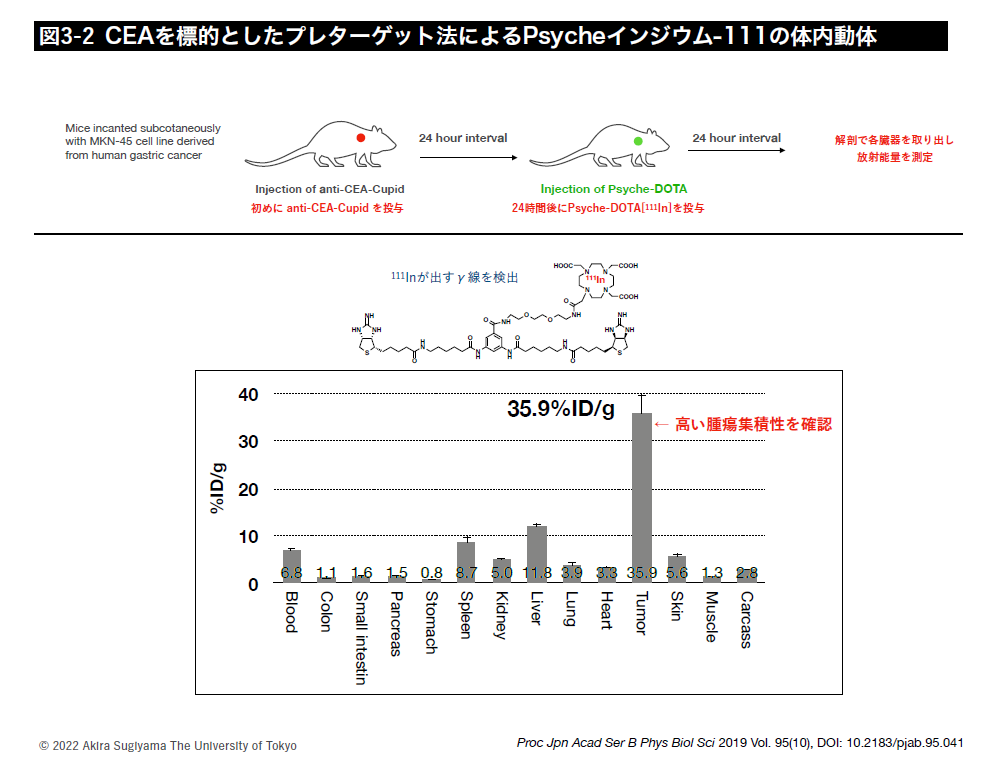
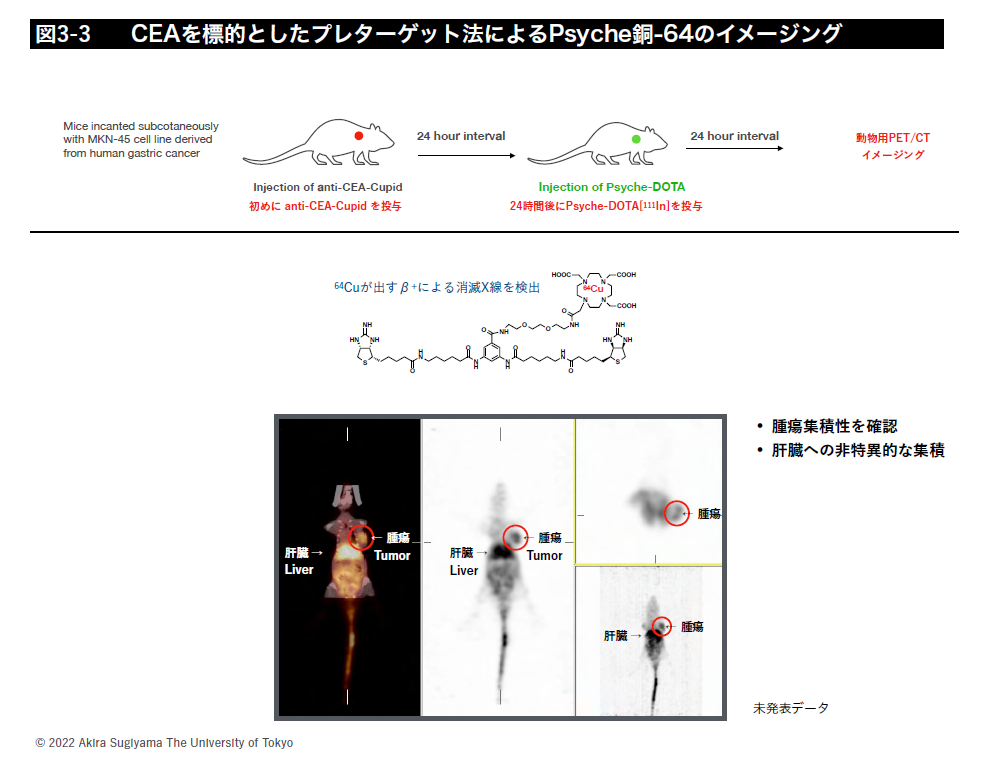
このシステムでは、放射性核種は、DOTAというキレート剤を用い、111In(SPECT用)、64Cu(PET用)などの診断用核種や90Y(β-線)、177Lu(β-線)、225Ac(α線)などの治療用核種をペイロードとしてがん細胞に送達できます(図3-1~3-3)。また、別の結合様式を使い211At(α線)などのハロゲンを標識しがん細胞へ送達することも可能です。しかし、放射性物質は常に放射線を出しており、放射線のオン・オフの制御はできないので、正常組織への副作用を可能な限り低減する為にプレターゲティング法という送達方法の確立を目指して本学薬学部、福島医科大学の研究者と共同で研究を進めています。共同研究では放射性薬剤が体内を長時間循環せずに目的の場所に速やかに集積し、結合していないものは、体外へ早期に排出されるような体内動態を持つペイロード分子の設計・合成や体内動体解析を進めています。マウスでの実験データを取得しつつ、特に細胞毒性の強いα線放出核種の内用療法の実用化に向け研究開発を進めています。
次世代結合薬の開発研究
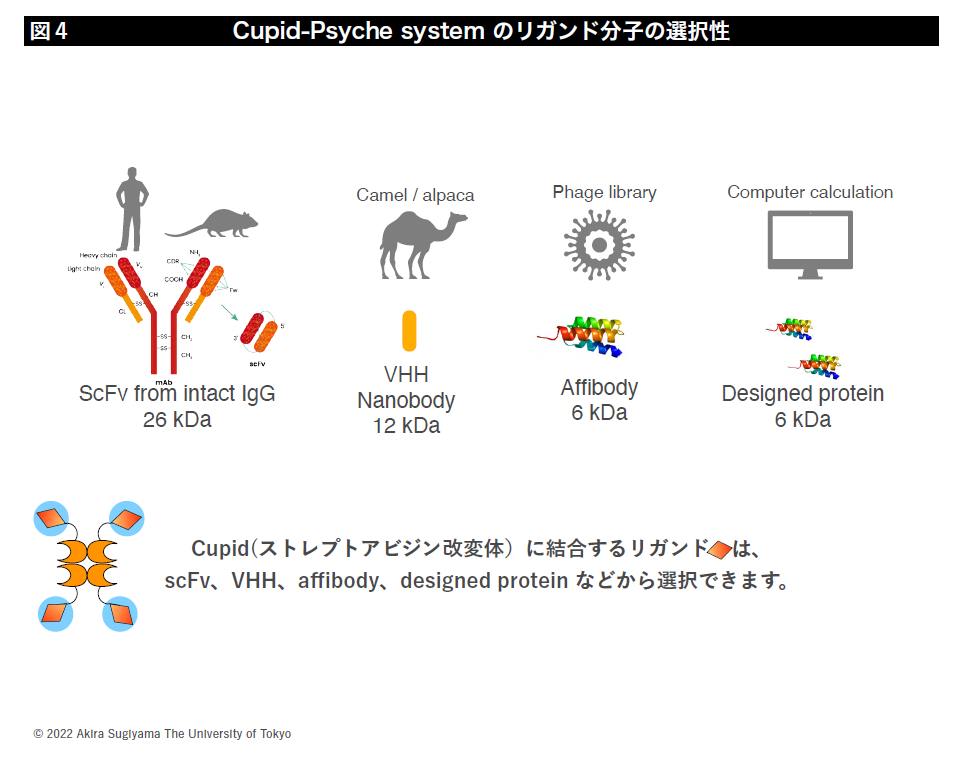
一方、がん細胞表面にある標的分子に結合し、ペイロードを運ぶための結合薬(タンパク分子)の設計・合成も行っています。標的分子に結合するリガンドには、ヒトやマウスのIgG抗体から作り出す一本鎖抗体(scFv: single chain variable fragment)、アルパカ由来のシングルドメイン抗体(VHH, nanobody)や抗体ミメティクス(affibody)を使用した実績があります(図4)。また、最近では分子動力学シミュレーションの研究者と共同で、計算機によるリガンド分子の設計にも取り組んでいます。リガンド分子に分子量が大きなscFv(26kD)では大量製造に問題がありましたが、分子量が小さなVHH(12kDa)やaffibody(6kDa)などを使用することで、大腸菌で迅速に目的のタンパク質を製造する方法を開発しました(文献DOI:10.1016/j.pep.2021.106043)。このことにより、計算機で設計された分子をすぐに結合薬として製造、活性評価につなげ、AIと計算機設計を組みあわせた新しい結合薬の製造プラットフォームの開発を進めています(図4)。
新しい治療標的、新しい放射性核種にも対応できるプラットフォーム技術
世界的に治療用の核種の研究開発が進められています。β線核種は90Yからより奏功率の高い177Luへシフトが見られております。α線核種は、211At、225Acなど核種を用い放射性医薬品開発が進められており、また、212Pbなどの新しい治療用核種の開発も進められています。
また、放射線の生体内での利用は、臨床における診断、治療の実用化に向けた取り組みだけでなく、基礎研究の方でも生体内での利用が進められています。具体的には、本学工学部の研究者が代表者として進めている学術変革領域研究(B)「もつれ光子対放出原子核と分子プローブの創成による生体内化学環境の医療診断」プロジェクトのように、放射性核種から放出される放射線が生体内化学環境による変化を捉えることが、検出理論の体系化、検出装置開発により可能なりこれらを医療に応用する基礎研究が開始されています。
我々は、実際の臨床的な診断、治療、だけでなく生体内に送達された放射性物質が出す放射線から得られる新しい生体環境情報の研究など、幅広いニーズに対応する標的ターティングプラットフォームの提供をめざし研究開発を進めています。
本研究に関する研究費
- AMED 「次世代がん研究シーズ戦略的育成プログラム (P-DIRECT)」
”PETイメージング診断とアイソトープDDS治療を統合する進行大腸がんプレターゲッティング治療薬の実用化”(研究開発分担者)、研究期間:平成26年度〜27年度 - AMED 「次世代がん医療創生研究事業 (P-CREATE)」
”転移性進行がんの診断と治療を可能にする革新的がん細胞ターゲッティングシステムの開発”(研究協力者)、研究期間:平成28年度〜29年度 - JSPS 「二国間交流事業 共同研究 JSPS-STINT (日本 - スウェーデン)」
”転移性がん治療を可能にするアスタチン-211を用いたプレターゲッティング医薬品開発”(研究参加者)、研究期間:平成29年度〜30年度 - AMED 「革新的がん医療実用化研究事業」
”アルファ線放出核種内用療法による難治がん治療薬の開発”(研究開発分担者) - 科研費 基盤(B) 、研究期間: 平成30年度〜令和2年度
“短寿命α線医薬品製造工程における被ばくを抑制するロボティック精製・標識技術の開発”(研究分担者、研究代表者:和田洋一郎(東京大学))、研究期間:2018-04-01 – 2021-03-31 - 科研費 基盤(B) “超選択的デリバリー短寿命α線を用いた胃癌腹膜播種内照射療法の実験的検討”(研究分担者、研究代表者:野村幸世(東京大学))、研究期間:2019-04-01 – 2022-03-31
- 科研費 基盤(B) “標的アルファ線治療におけるプレターゲティング法の最適化と複数がん種への適応”(研究分担者、研究代表者:鷲山幸信(福島県立医科大学))、研究期間:2020-04-01 – 2023-03-31
- 科研費 基盤(B) “がん幹細胞をターゲットとしたα線放出核種を用いた革新的な白血病治療法の開発”(研究分担者、研究代表者:趙松吉(福島県立医科大学))、研究期間:2020-04-01 – 2023-03-31
- 科研費 基盤(B) “進行がんの次世代Antibody Drug Conjugate 治療薬の創成“(研究代表者)、研究期間:2021-04-01 – 2024-03-31
- 文科省 学術変革領域研究(B) “もつれ光子対放出原子核と分子プローブの創成による生体内化学環境の医療診断”(研究分担者)、研究期間:2022-05-20 – 2025-03-31
- AMED 「次世代がん医療加速化研究事業」 “腫瘍微小環境の代謝ネットワークを制御するAI セラノスティクスの開発”(研究開発分担者)、研究期間:2022-05-20 – 2025-03-31
- 科研費 国際共同研究加速基金(国際共同研究強化(B)) 「Radio-theranostics技術の開発、および国際共同研究コンソーシアムの構築」(研究分担者)、研究期間:2022-10-07 – 2026-03-31
- 科研費 基盤(A) “α線放出核種と抗体ドラッグデリバリーシステムによる新規放射性医薬品の開発”(研究分担者)、研究期間:2023-04-01 – 2027-03-31
研究論文
* Corresponding author(責任著者)
1*, Yumura, K. et al. Mutations for decreasing the immunogenicity and maintaining the function of core streptavidin. Protein Sci 22, 213-221 (2013). https://doi.org:10.1002/pro.2203
2*, Kawato, T. et al. Crystal structure of streptavidin mutant with low immunogenicity. J Biosci Bioeng 119, 642-647 (2015). https://doi.org/10.1016/j.jbiosc.2014.10.025
3*, Kawato, T. et al. Structure-based design of a streptavidin mutant specific for an artificial biotin analogue. J Biochem 157, 467-475 (2015). https://doi.org/10.1093/jb/mvv004
4*, Kawato, T. et al. Structure-based design and synthesis of a bivalent iminobiotin analog showing strong affinity toward a low immunogenic streptavidin mutant. Biosci Biotechnol Biochem 79, 640-642 (2015). https://doi.org/10.1080/09168451.2014.991692
5, Tachibana, K. et al. Analysis of the subcellular localization of the human histone methyltransferase SETDB1. Biochem Biophys Res Commun 465, 725-731 (2015). https://doi.org:10.1016/j.bbrc.2015.08.065
6, Kado, Y. et al. Epiregulin Recognition Mechanisms by Anti-epiregulin Antibody 9E5: STRUCTURAL, FUNCTIONAL, AND MOLECULAR DYNAMICS SIMULATION ANALYSES. J Biol Chem 291, 2319-2330 (2016). https://doi.org/10.1074/jbc.M115.656009
7, Sugiyama, A. et al. Cupid and Psyche system for the diagnosis and treatment of advanced cancer. Proc Jpn Acad Ser B Phys Biol Sci 95, 602-611 (2019). https://doi.org/10.2183/pjab.95.041
8, Takahashi, K. et al. Axially Substituted Silicon Phthalocyanine Payloads for Antibody-Drug Conjugates. Synlett 32, 1098-1103 (2021). https://doi.org/10.1055/a-1503-6425
9, Kaneko, Y. et al. The serological diversity of serum IgG/IgA/IgM against SARS-CoV-2 nucleoprotein, spike, and receptor-binding domain and neutralizing antibodies in patients with COVID-19 in Japan. Health Sci Rep 5, e572 (2022). https://doi.org/10.1002/hsr2.572
10*, Kaneko, Y. et al. Pathological complete remission of relapsed tumor by photo-activating antibody-mimetic drug conjugate treatment. Cancer Sci 113, 4350-4362 (2022). https://doi.org/10.1111/cas.15565
11, Kobashi, Y. et al. Humoral immunity after second dose of BNT162b2 vaccine in Japanese communities: an observational cross-sectional study, Fukushima Vaccination Community Survey. Sci Rep 12, 18929 (2022). https://doi.org/10.1038/s41598-022-21797-x
12*, Yamatsugu, K. et al. Antibody mimetic drug conjugate manufactured by high-yield Escherichia coli expression and non-covalent binding system. Protein Expr Purif 192, 106043 (2022). https://doi.org/10.1016/j.pep.2021.106043
13, Furuya, G. et al. Nucleic acid-triggered tumoral immunity propagates pH-selective therapeutic antibodies through tumor-driven epitope spreading. Cancer Sci 114, 321-338 (2022). https://doi.org/10.1111/cas.15596
14, Kawashima, M. et al. Antibody and T-Cell Responses against SARS-CoV-2 after Booster Vaccination in Patients on Dialysis: A Prospective Observational Study. Vaccines 11, 260 (2023). http://dx.doi.org/10.3390/vaccines11020260
15, Tani, Y. et al. Varying Cellular Immune Response against SARS-CoV-2 after the Booster Vaccination: A Cohort Study from Fukushima Vaccination Community Survey, Japan. Vaccines 11, 920 (2023). http://dx.doi.org/10.3390/vaccines11050920
16, Tani, Y. et al. Five doses of the mRNA vaccination potentially suppress ancestral-strain stimulated SARS-CoV2-specific cellular immunity: a cohort study from the Fukushima vaccination community survey, Japan. Front. Immunol., 14, (2023). https://doi.org/10.3389/fimmu.2023.1240425
17*, Sakata, J. et al. Antibody-mimetic drug conjugate with efficient internalization activity using anti-HER2 VHH and duocarmycin. Protein Expr Purif. 2023 Oct 3:106375. doi: 10.1016/j.pep.2023.106375. Online ahead of print.
18, Shimazoe, K., Donghwan, K., Mineo, T. et al. pH dependence of perturbed angular correlation in DOTA chelated In-111 measured with ring-shape gamma-ray detectors. Hyperfine Interact 245, 22 (2024). https://doi.org/10.1007/s10751-024-01864-7

