ANGPTL4はHIF1αおよびPPARβ/δの結合領域が立体構造上近接関係をきたすことによって相乗的に誘導される
異なる刺激による相乗的な遺伝子発現現象については、従来様々なメカニズムが報告されている.東京大学先端科学技術研究センター(所長、西村幸夫)システム生物医学分野の井上剛(いのうえ つよし)研究員(現、東京大学病院腎臓内科、バージニア大学)と田中十志也特任准教授、児玉龍彦教授、アイソトープ総合センターの神吉康晴助教、和田洋一郎教授らの研究グループは複数の刺激のよる協調的遺伝子発現では、クロマチン構造の相乗的変化が関与する新たなメカニズムを見出した.本内容は2014年4月10日付でGenome Biology誌電子版に掲載された。
血管内皮細胞を用いてhypoxia-inducible factor(HIF)1依存的遺伝子発現を詳細に検討した結果,HIF1およびperoxisome proliferator-activated receptor (PPAR)β/δのクロストークの存在が推測され、ヒト臍帯静脈血管内皮細胞(HUVEC)を用いたmigration assayによって,両方の刺激による相乗的な作用が確認された.そこで、マイクロアレイによる網羅的遺伝子発現解析を実施したところ、Angiopoietin-like 4(ANGPTL4)が低酸素刺激(1%酸素,24時間で20.1倍)でも,PPARβ/δアゴニスト投与(7.0倍)でも最も効率良く誘導され、相乗刺激によって35.3倍誘導される事を見い出した. ChIP-seqとレポーターアッセイによって, ANGPTL4遺伝子周囲でこの相乗効果において機能的に重要なPPAR結合部位(PPRE)およびHIF結合部位(HRE)を同定した.アクティブなエンハンサーマークであるヒストン修飾(H3K27ac)のプロフィールから,この2つの転写因子の結合領域の近接関係が相乗的な遺伝子発現と関与していると考え、ライフテクノロジー社が開発した定量的chromosome conformation capture(3C)アッセイを用いて,この近接関係を直接示した(図).今回のわれわれの研究は,二つの異なる転写因子を介した相乗作用が,遺伝子のクロマチン立体構造を介して引き起こされていることを示した最初の報告である.
尚、本研究は、東京大学先端科学技術研究センターシステム生物医学ラボラトリーのゲノムサイエンス部門、シンガポールゲノム研究所、コネチカット州立大学ジャクソンラボラトリー、自治医科大学との共同研究である。
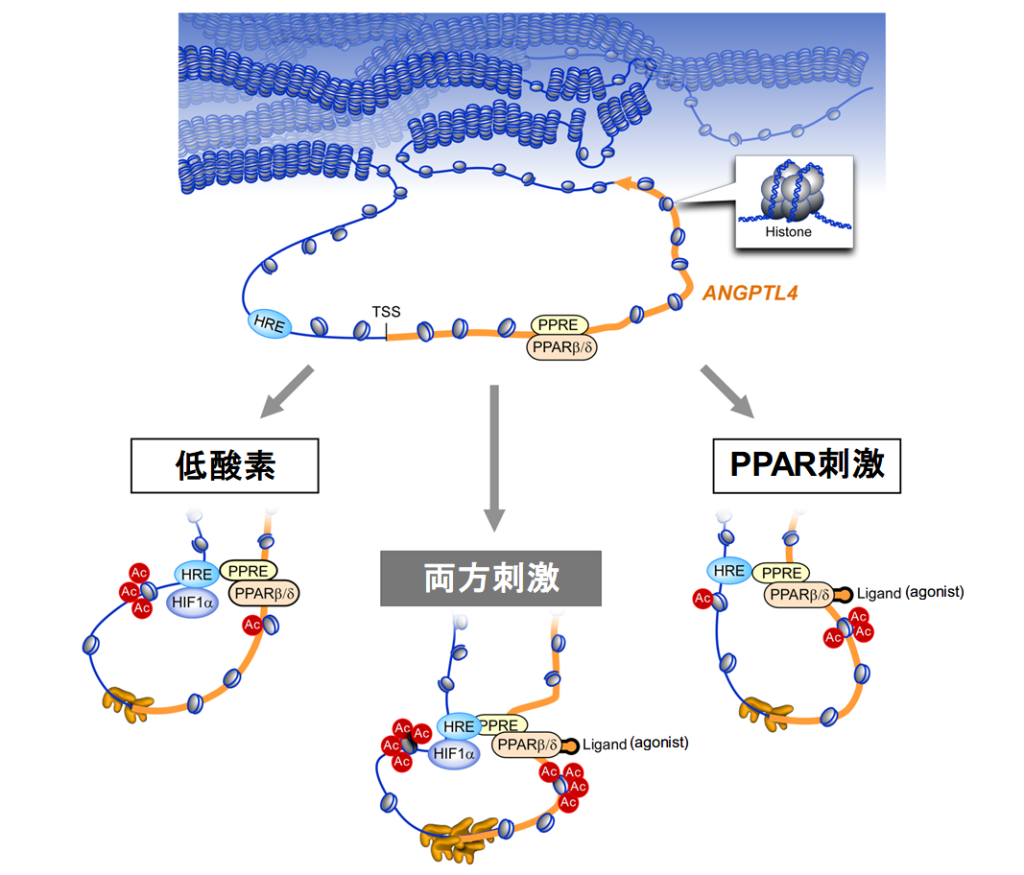
Cross-enhancement of ANGPTL4 transcription by HIF1 alpha and PPAR beta/delta is the result of the conformational proximity of two response elements.
Inoue T, Kohro T, Tanaka T, Kanki Y, Li G, Poh HM, Mimura I, Kobayashi M, Taguchi A, Maejima T, Suehiro JI, Sugiyama A, Kaneki K, Aruga H, Dong S,Stevens JF, Yamamoto S, Tsutsumi S, Fujita T, Ruan X, Aburatani H, Nangaku M, Ruan Y, Kodama T, Wada Y.
Genome Biol. 2014 Apr 10;15(4):R63. [Epub ahead of print]
