松本 博樹

東京大学 アイソトープ総合センター 社会連携部門 特任教授
昭和大学薬学部 衛生薬学部門 客員教授 兼任
国立がんセンター中央病院 放射線診断科 客員研究員 兼任
第一種放射線取扱主任者
専門分野
放射性医薬品科学
2024年1月1日、東京大学アイソトープ総合センターで初めて設置された社会連携部門に特任教授として着任致しました。ラジオアイソトープ(RI)*1の際立った特徴を活かした医薬品の開発に取り組んでいます。画期的な新薬を一日も早く社会実装していくことで、がんを始めとする難病の克服を目指して日々チャレンジを続けています。
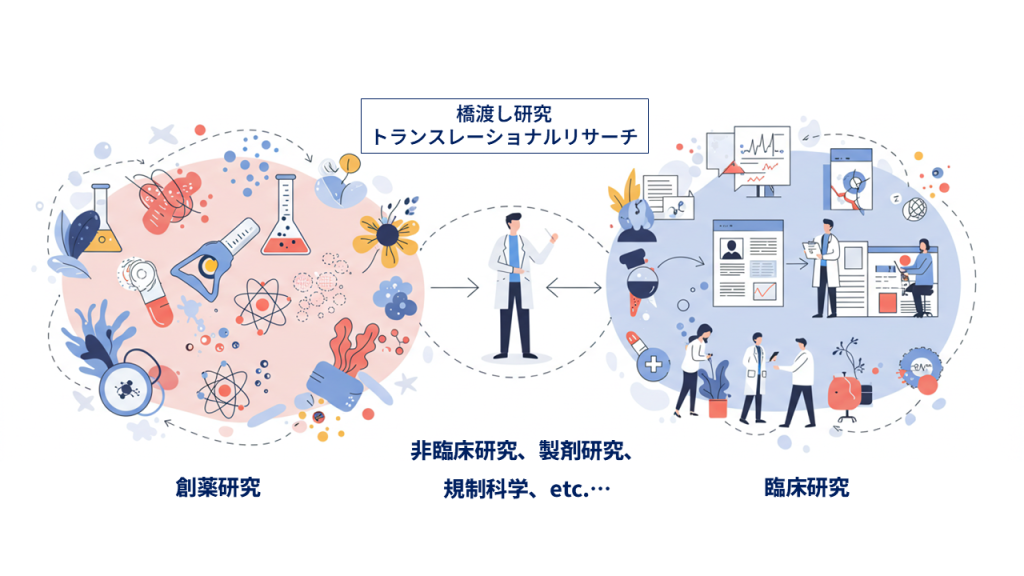
【研究内容】
1. 創薬研究
現在利用可能な治療法では効果が限定的である難治性疾患に対して、RIの特徴を活かすことで新たな治療選択肢を提供することを目指し、創薬研究に取り組んでいます。対象とする難治性疾患に特徴的な分子生物学的・細胞生物学的な変化を標的とし、RIを標的に届けるための薬剤設計を行い、疾患モデル動物を用いて作用のメカニズムを検証しています。
2. 非臨床研究・橋渡し研究(トランスレーショナルリサーチ)
創薬研究により見出された有望なRI医薬品候補について、その安全性と有効性を動物や細胞等を用いて評価し、臨床試験を開始できるか十分に検討します。臨床試験で想定される対象患者、投与経路、投与量などから、適切な非臨床試験の構成を検討します。RI医薬品候補については、その体内での動きに基づき内部被ばくについて評価することも重要です。RI医薬品候補を臨床試験で安全に投与するため、治験薬GMP*2という基準に則って製造方法と品質試験方法の開発も行います。
実際の臨床の現場でRI医薬品候補がどのように使われるのか、その安全性と有効性とを評価するためにはどのような臨床試験を行えばよいのかを検討し、非臨床試験の構成を検討することが重要です。この検討に際しては、PMDA*3のRS戦略相談*4の枠組みを活用し、規制当局と議論しています。このように、創薬研究と臨床試験との間を円滑につなぐための研究を「橋渡し研究(トランスレーショナルリサーチ)」と呼びます。日本では過去にRI医薬品の橋渡し研究についての実績がなく、海外で開発が先行されたものを輸入していましたが、私たちのグループではこれまでに、臨床研究中核病院*5の強力なサポートを頂いて、日本で見出されたRI医薬品候補について世界で初めて日本で臨床研究を開始した実績を積んできました。
「RI医薬品の橋渡し研究」が、私たちの研究の大きな柱です。
3. 臨床研究支援
医薬品候補を用いて国の承認を得るための成績を集める臨床試験を「治験」と呼びます。RI医薬品候補の治験には、他の医薬品候補にはない独特の性質があります。RI医薬品候補の治験に用いる治験薬は、RIが減衰*6するため貯蔵することができず、投与日毎に少ない本数での頻回の製造が必要となります。このようなRI治験薬の事情に応じた製造と品質試験の実施について、治験薬GMP対応施設に協力しています。またRI治験薬の薬物動態の解析や代謝物の分析には一般の医薬品とは異なる手法が必要となります。RI治験薬に特有の内部被ばくの評価も必要となり、これらについて治験実施施設を支援しています。
用語解説
*1ラジオアイソトープ(RI):化学的性質は同じでも、重さが少しだけ違う原子(元素)をアイソトープ(同位元素)と呼ぶ。アイソトープのうち放射線を出すものがラジオアイソトープ(RI)である。
*2治験薬GMP:治験薬を製造する際に遵守すべき適切な製造管理及び品質管理の方法並びに必要な構造設備に関する事項について、厚生労働省医薬食品局長より発出された通知(薬食発第0709002号、平成20年7月9日、治験薬の製造管理、品質管理等に関する基準)
*3PMDA:独立行政法人医薬品医療機器総合機構。医薬品、医療機器、再生医療等製品等の品質、有効性、安全性について承認審査を行う。
*4RS戦略相談:レギュラトリーサイエンス戦略相談の略。PMDAが主に大学、研究機関、ベンチャー企業を対象として、医薬品等の開発製品候補選定の最終段階から、主に臨床開発初期に至るまでに必要な試験・治験計画策定等に関して、指導・助言を行う。
*5臨床研究中核病院:日本発の革新的な医薬品等の開発を推進するための中心的役割を担う病院として医療法上に位置づけられたもので、厚生労働大臣の認可を受けて指定される。
*6減衰: RIの放射能は、時間がたつにつれて弱まる性質があり、これを減衰という。また、放射能が半分に減るまでにかかる時間を「半減期」あるいは「物理学的半減期」という。RIの種類によって半減期は異なり、医療に用いられるRIの半減期は数時間から数日のものが多い。
【原著論文】
創薬研究
- 64Cu2+ Complexes of Tripodal Amine Ligands’ In Vivo Tumor and Liver Uptakes and Intracellular Cu Distribution in the Extrahepatic Bile Duct Carcinoma Cell Line TFK-1: A Basic Comparative Study. Shinada, M.; Takahashi, M.; Igarashi, C.; Matsumoto, H.; Hihara, F.; Tachibana, T.; Oikawa, M.; Suzuki, H.; Zhang, M.-R.; Yoshii, Y.; et al. Pharmaceuticals 2024, 17, 820.
- Trace Metal Impurities Effects on the Formation of [64Cu]Cu-diacetyl-bis(N4-methylthiosemicarbazone) ([64Cu]Cu-ATSM). Shinada, M.; Suzuki, H.; Hanyu, M.; Igarashi, C.; Matsumoto, H.; Takahashi, M.; Hihara, F.; Tachibana, T.; Sogawa, C.; Zhang, M.-R.; Higashi, T.; Sato, H.; Kurihara, H.; Yoshii, Y.; Doi, Y. Pharmaceuticals 2024, 17, 10.
- An In Vivo Dual-Observation Method to Monitor Tumor Mass and Tumor-Surface Blood Vessels for Developing Anti-Angiogenesis Agents against Submillimeter Tumors. Tachibana, T.; Oyama, T.G.; Yoshii, Y.; Hihara, F.; Igarashi, C.; Shinada, M.; Matsumoto, H.; Higashi, T.; Kishimoto, T.; Taguchi, M. Int. J. Mol. Sci. 2023, 24, 17234.
- In Vitro Tumor Cell-Binding Assay to Select High-Binding Antibody and Predict Therapy Response for Personalized 64Cu-Intraperitoneal Radioimmunotherapy against Peritoneal Dissemination of Pancreatic Cancer: A Feasibility Study. Hihara, F.; Matsumoto, H.; Yoshimoto, M.; Masuko, T.; Endo, Y.; Igarashi, C.; Tachibana, T.; Shinada, M.; Zhang, M.-R.; Kurosawa, G.; et al. Int. J. Mol. Sci. 2022, 23, 5807.
- Efficacy of vorinostat-sensitized intraperitoneal radioimmunotherapy with 64Cu-labeled cetuximab against peritoneal dissemination of gastric cancer in a mouse model. Tachibana T, Yoshii Y, Matsumoto H, Higashi T, et al. J Cancer Res Ther. 2022 Jul-Sep;18(4):907-914.
- Usefulness of PET-guided surgery with 64Cu-labeled cetuximab for resection of intrapancreatic residual tumors in a xenograft mouse model of resectable pancreatic cancer. Igarashi C, Yoshii, Y, Matsumoto H, et al. Nuclear Medicine Communications 42(10):p 1112-1121, October 2021.
- Immuno-OpenPET: a novel approach for early diagnosis and image-guided surgery for small resectable pancreatic cancer. Yoshii Y, Matsumoto H, Higashi T, et al. Sci Rep 2020, 10, 4143.
- Comparative evaluation of [18F]DiFA and its analogs as novel hypoxia positron emission tomography and [18F]FMISO as the standard. Nakata N, Kiriu M, Okumura Y, Zhao S, Nishijima KI, Shiga T, Tamaki N, Kuge Y, Matsumoto H. Nucl Med Biol. 2019;70:39-45
- 64Cu-intraperitoneal radioimmunotherapy: a novel approach for adjuvant treatment in a clinically relevant preclinical model of pancreatic cancer. Yoshii Y, Matsumoto H, Yoshimoto M, Oe Y, Zhang MR, Nagatsu K, Sugyo A, Tsuji AB, Higashi T. J Nucl Med. 2019 doi: 10.2967/jnumed.118.225045.
- Biodistribution and radiation dosimetry of the novel hypoxia PET probe [18F]DiFA and comparison with [18F]FMISO. Watanabe S, Shiga T, Hirata K, Magota K, Okamoto S, Toyonaga T, Higashikawa K, Yasui H, Kobayashi J, Nishijima KI, Iseki K, Matsumoto H, Kuge Y, Tamaki N. EJNMMI Res. 2019:5;9(1):60
- A Novel PET Probe "[18F]DiFA" Accumulates in Hypoxic Region via Glutathione Conjugation Following Reductive Metabolism. Shimizu Y, Matsumoto H, et al., Mol Imaging Biol 2019;21(1):122-129.
- Design, Synthesis, and Preliminary Evaluation of SPECT Probes for Imaging β-Amyloid in Alzheimer's Disease Affected Brain. Okumura Y, Matsumoto H, et al., ACS Chem Neurosci. 2018;9(6):1503-1514.
- Integrated treatment using intraperitoneal radioimmunotherapy and positron emission tomography-guided surgery with 64Cu-labeled cetuximab to treat early- and late-phase peritoneal dissemination in human gastrointestinal cancer xenografts. Yoshii Y, Matsumoto H, et al., Oncotarget. 2018:9(48); 28935- 28950.
- 64Cu-ATSM internal radiotherapy to treat tumors with bevacizumab-induced vascular decrease and hypoxia in human colon carcinoma xenografts. Yoshii Y, Matsumoto H, et al., Oncotarget. 2017 28;8(51): 88815-88826.
- The Thymidine Phosphorylase Imaging Agent 123I-IIMU Predicts the Efficacy of Capecitabine. Kobashi N, Matsumoto H, Kuge Y et al., J Nucl Med 2016; 57:1276–1281.
- A novel CYP11B2-specific imaging agent for detection of unilateral subtypes of primary aldosteronism. Abe T, Naruse M, Matsumoto H et al. J Clin Endocrinol Metab. 2016, 101(3):1008–1015
- 64Cu-ATSM therapy targets regions with activated DNA repair and enrichment of CD133+ cells in an HT-29 tumor model: Sensitization with a nucleic acid antimetabolite. Yoshii Y, Furukawa T, Matsumoto H, et al. Cancer Letters 2016;376:74–82.
- Evaluation of trans-1-amino-3-18F-fluorocyclobutanecarboxylic acid accumulation in low-grade glioma in chemically induced rat models: PET and autoradiography compared with morphological images and histopathological findings. Doi Y, Kanagawa M, Matsumoto H et al. Nucl Med Biol. 2015, 42:664-672.
- Controlled administration of penicillamine reduces radiation exposure in critical organs during 64Cu-ATSM internal radiotherapy: a novel strategy for liver protection. Yoshii Y, Matsumoto H, Sogawa C, et al., PLoS ONE 2014;9(1):e86996
橋渡し研究
- Process to Remove the Size Variants Contained in the Antibody–Chelator Complex PCTA-NCAB001 for Radiolabeling with Copper-64. Yoshii, Y.; Matsumoto, H.; Igarashi, C.; Tachibana, T.; Hihara, F.; Shinada, M.; Waki, A.; Yoshida, S.; Naito, K.; Ito, K.; Higashi, T.; Kurihara H.; Ueno M. Pharmaceuticals 2023, 16, 1341. doi:10.3390/ph16101341
- Preclinical Safety Evaluation of Intraperitoneally Administered Cu-Conjugated Anti-EGFR Antibody NCAB001 for the Early Diagnosis of Pancreatic Cancer Using PET. Matsumoto, H.; Igarashi, C.; Tachibana, T.; Hihara, F.; Shinada, M.; Waki, A.; Yoshida, S.; Naito, K.; Kurihara, H.; Ueno, M.; et al. Pharmaceutics 2022, 14, 1928.
- Characterization and Stabilization of a New 64Cu-Labeled Anti-EGFR Antibody NCAB001 for the Early Detection of Pancreatic Cancer with Positron Emission Tomography. Matsumoto, H.; Igarashi, C.; Tachibana, T.; Hihara, F.; Waki, A.; Zhang, M.-R.; Yoshida, S.; Naito, K.; Kurihara, H.; Ueno, M.; et al. Pharmaceutics 2022, 14, 67.
- Identification and quantitative structure–activity relationship assessment of trace chemical impurities contained in the therapeutic formulation of [64Cu]Cu-ATSM. Igarashi C, Matsumoto H, Yoshii Y, et al. Nuclear Medicine and Biology. 2022.108–109: 10-15.
- Evaluation of 64Cu-labeled new anti-EGFR antibody NCAB001 with intraperitoneal injection for early PET diagnosis of pancreatic cancer in orthotopic tumor-xenografted mice and nonhuman primates. Matsumoto, H.; Watabe, T.; Igarashi, C.; Tachibana, T.; Hihara, F.; Waki, A.; Zhang, M.-R.; Tashima, H.; Yamaya, T.; Ooe, K.; et al. Pharmaceuticals 2021, 14, 950.
- Process development of [64Cu]Cu-ATSM: efficient stabilization and sterilization for therapeutic applications. Matsumoto H, Igarashi C, Kaneko E, Hashimoto H, Suzuki H, Kawamura K, Zhang M-R, Higashi T, Yoshii Y. J Radioanal Nucl Chem 2019;322:467-475.
- Preclinical pharmacokinetic and safety studies of copper-diacetyl-bis(N4- methylthiosemicarbazone) (Cu-ATSM): translational studies for internal radiotherapy. Matsumoto H, Yoshii Y, Baden A, Kaneko E, Hashimoto H, Suzuki H, Kawamura K, Zhang M-R, Higashi T, Kurihara H. Transl Oncol 2019;12:1206-1212.
- Multiple Administrations of 64Cu-ATSM as a Novel Therapeutic Option for Glioblastoma: a Translational Study Using Mice with Xenografts. Yoshii Y, Matsumoto H, et al., Transl Oncol. 2018;11(1):24-30.
臨床研究
- Phase I clinical trial of 64Cu-ATSM for malignant brain tumors. Kurihara H, Narita Y, Matsumoto H, et al. J Clin Oncol 42, 2024 (suppl 16; abstr 2052)
- 放射性治療薬[64Cu]Cu-ATSM投与後の治療病室における空気中の放射能濃度.伊藤 公輝, 栗原 宏明, 松本 博樹, 立花 知子, 吉井 幸恵, 成田 善孝, 細野 眞.核医学, 2025, 62 巻, p. 1-6.
【研究にかかわった競争的資金】
国立研究開発法人日本医療研究開発機構(AMED)
臨床研究・治験推進研究事業(令和4年度~令和7年度)
「膵がん早期発見・精密治療方針決定を実現する新規放射性抗体医薬を用いた超音波内視鏡ガイド投与による革新的PET画像診断の第I相医師主導治験」(研究開発分担者)
臨床研究・治験推進研究事業(令和5年度~令和8年度)
「再発・難治性悪性神経膠腫に対する治療用放射性薬剤64Cu-ATSMの有効性を検証する研究開発」(研究開発分担者)
国立研究開発法人科学技術研究開発機構(JST)
研究成果展開事業 大学発新産業創出プログラム プロジェクト支援型(令和2年度~令和4年度)
「革新的がん放射性治療薬の事業化に向けた技術開発」(研究開発参加者)

